La leishmaniose cutanée est une maladie due à un protozoaire intra-cellulaire du genre leishmania (on en dénombre plus d’une vingtaine). A côté du parasite, la maladie implique un réservoir de virus qui peut être un rongeur, le chien ou même l’homme et enfin un vecteur qui est un insecte le phlébotome.
Ces trois facteurs varient en fonction des régions, ce qui implique des manifestations cliniques et des attitudes thérapeutiques variables.
C’est une maladie endémique dans certaines régions du monde, par exemple en Afrique du Nord, au Moyen Orient et en Amérique latine. Selon l’OMS, 1 à 1,5 millions de nouveaux cas sont enregistrés annuellement.
Classiquement, trois grandes variétés sont reconnues :
La leishmaniose cutanéo-muqueuse du nouveau monde (Espundia) dont plusieurs espèces en sont responsables,
Celle de l’ancien monde (bouton d’orient) où on recense essentiellement deux espèces : L Tropica, L. Major, L. Killicki et à un degré moindre : L. Infantum et L. aethopica.
Et la leishmaniose viscérale ou Kala-azar due à L. infantum et L. donovani.
On va focaliser sur la leishmaniose cutanée qui est endémique en Afrique du Nord et au Moyen Orient, d’autant plus que plusieurs faits caractérisent cette variété. Ils sont d’ordre:
1 - Epidémiologique : en fait, trois grandes formes épidémio - cliniques sont reconnues:
La leishmaniose cutanée anthroponotique due à L. tropica
La leishmaniose cutanée zoonotique due à L. major
La leishmaniose cutanée sporadique due à L. killicki
Accessoirement, la leishmaniose viscérale due à L.infantum et L.donovani peut avoir des manifestations cutanées dites post-Kala-Azar (1,2). En fait, l’attribution d’un parasite déterminé à une forme clinique précise n’est pas toujours vérifiée. On citera comme exemple celui du L.tropica qui peut être responsable et de la forme anthroponotique et de la forme zoonotique (3). Si la leishmaniose viscérale est en nette diminution, la leishmaniose cutanée continue à sévir dans pas mal de régions, dû aux déplacements souvent forcés des populations dans les zones de guerre et également aux changements climatiques (2,4). Les études iso-enzymatiques continuent d’identifier plusieurs zymodemes pour chaque espèce (5).
2 - Clinique : la leishmaniose cutanée illustre le polymorphisme clinique par excellence. L’aspect des lésions dépend de la virulence du parasite et de l’état immunitaire du patient.
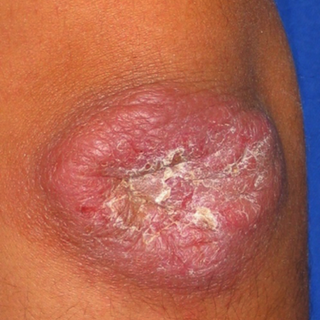
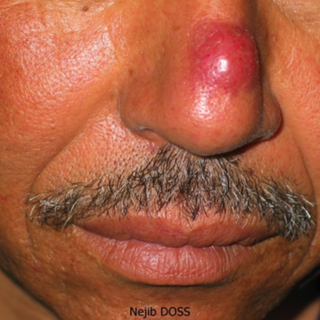
Certaines études ont rapporté des correspondances entre certaines manifestations cliniques et l’espèce en cause (1;2). Même si les composantes ulcéreuse et croûteuse soient les plus marquantes, plusieurs autres variétés sont rapportées : forme sèche (fig.1,2,3) forme humide (fig.4,5),forme infiltrée (fig.6,7) forme sporotrichoide (fig.8), forme nodulaire (fig.9,10), forme vésiculeuse (fig.11), forme avec atteinte multiple(fig.12). Ces différentes formes sont à l’origine de retards diagnostiques et par conséquent de retards dans la prise en charge.
Les lésions commencent le plus souvent par une papule érythémateuse (endroit de la piqûre), puis elle s’étend pour devenir nodulaire. Une ulcération se surajoute avec des croûtes. Un dénominateur commun à ces lésions est représenté par la chronicité, le bon état général du patient, un séjour dans une zone d’endémie et l’absence de réponse à un traitement antibiotique souvent prescrit en première intention vu la ressemblance clinique avec des lésions bactériennes. En fait le spectre clinique des lésions est très large,et la leishmaniose cutanée peut mimer plusieurs pathologies cutanées, à savoir: sarcoidose, tuberculose, sporotrichose, furoncle, rosacée, impétigo, chromomycose,…
La leishmaniose cutanée peut être carrément dé figurante avec un impact psychologique important. Les formes récidivantes sont également connues et elles seraient en rapport avec un déficit immunitaire du patient.
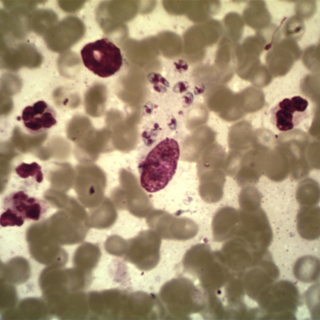
3 - Diagnostique : En zone d’endémie, le diagnostic est fortement évoqué sur les données cliniques et anamnestiques, néanmoins, il faut une confirmation parasitologique (examen direct) faite par un prélèvement au niveau de la lésion afin de mettre en évidence les formes amastigotes du parasite (fig.13), cet examen peut revenir négatif en cas de surinfection bactérienne. Une biopsie cutanée peut être demandée afin de confirmer le diagnostic. De nouvelles méthodes diagnostiques plus fines, en particulier la dermoscopie qui montrerait dont les images varient en fonction de la forme clinique, mais certaines sont hautement évocatrices de leishmaniose cutanée, à savoi r: erythème généralisé, « larmes jaunes », des structures vasculaires variables de (fig.14). La microscopie confocale a été également utilisée afin de conforter le diagnostic. Les investigations biologiques à savoir le PCR peuvent être demandées dans certaines conditions (2,6,7,8).
4 - Thérapeutique : les lésions de leishmaniose cutanées évoluent spontanément vers la guérison sur une période de six à douze mois, mais au prix d’une cicatrice inesthétique. Plusieurs protocoles thérapeutiques sont disponibles et le choix dépend essentiellement du siège des lésions et de leur nombre. Parmi ces traitements, les sels d’antimoine demeurent les plus prescrits.
Traitements locaux :
Injections intra-lésionnelles de Meglumine antimoniate, le nombre des injections et leur périodicité varie en fonction de la taille et de l’évolution sous traitement.
Thermothérapie: le parasite est sensible à la chaleur, et par conséquent tout procédé qui augmenterait la chaleur locale est en mesure de réduire la virulence du parasite. Le traitement par azote liquide s’inscrit dans cette optique.
La paromomycine à15% seule ou associée à la Gentamycine à raison de deux applications par jour, a été également essayée en Tunisie avec des résultats prometteurs (9).
Une réduction de la « masse tumorale » associée à l’imiquimod a été également essayée (10).
Traitements Systémiques :
La molécule la plus utilisée est le Meglumine antimoniate à raison de 10 à 20 mg/kg/jour en injections intra musculaires pour une durée de 2-3 semaines.
Fluconazole, Ketoconazole et metronidazole ont été utilisées surtout en cas de contre-indication des sels d’antimoine, maisavec des résultats moindres.
Traitements Préventifs :
La prise en charge ne pourrait se concevoir sans la composante préventive avec l’usage des moustiquaires, la lutte contre les réservoirs de virus, la déclaration des cas diagnostiqués et les séances de sensibilisation pour les personnes vivant dans des zones d’endémie.
La leishmaniose cutanée demeure une maladie fréquente avec le statut d’une maladie considérée comme négligée selon l’OMS. Il faut garder en mémoire ce diagnostic par ces temps où il y a beaucoup de déplacements (forcés ou non) de populations. L’introduction de traitements dits biologiques dans plusieurs indications serait à l’origine de l’éclosion de certains foyers. Les différents traitements proposés ne doivent pas faire oublier l’importance des mesures préventives, capitales afin de réduire de l’impact de la maladie.
Références :
Mokni M. Cutaneous leishmaniasis. Ann Dermatol Venereol. 2019 Mar;146(3):232-246.
Burza S, Croft SL, Boelaert M. Leishmaniasis. The Lancet 2018 Sep 15, 392(1015):951-970.
Farash BRH, Shamsian SAA, Mohajery M, Fata A, Sadabadi F, Berenji F, Mastroeni P, Poustchi E1, Moghaddas E, Sangani GS, Farnoosh G. Changes in the Epidemiology of Cutaneous Leishmaniasis in Northeastern Iran Turkiye Parazitol Derg. 2020 Mar 20;44(1):52-57.
Sakhaei S, Darrudi R, Motaarefi H, Sadagheyani HE. Epidemiological Study of Cutaneous Leishmaniasis in Neyshabur County, East of Iran (2011-2017). Open Access Maced J Med Sci. 2019 Sep 13;7(21):3710-3715.
Chaara D, Haouas N, Dedet JP, Babba H, Pratlong F. Leishmaniases in Maghreb: an endemic neglected disease. Acta Trop. 2014 Apr;132:80-93.
Gamze Serarslan , Özlem Ekiz, Cahit Özer, Gökhan Sarıkaya. Dermoscopy in the Diagnosis of Cutaneous Leishmaniasis. Dermatol Pract Concept. 2019 Apr 30;9(2):111-118.
Marija Buljan, Iris Zalaudek , Cesare Massone , Rainer Hofmann-Wellenhof, Regina Fink-Puches, Edith Arzberger Dermoscopy and Reflectance Confocal Microscopy in Cutaneous Leishmaniasis on the Face. Australas J Dermatol . 2016 Nov;57(4):316-318.
A Llambrich , P Zaballos, F Terrasa, I Torne, S Puig, J Malvehy Dermoscopy of Cutaneous Leishmaniasis Br J Dermatol . 2009 Apr;160(4):756-61.
Ben Salah A, Ben Messaoud N, Guedri E, et al. Topical paromomycin with or without gentamicin for cutaneous leishmaniasis. N Engl J Med 2013; 368: 524–32.
Laura A Taylor , Rachel Gormley, Carrie Kovarik Leishmania Tropica: Combined Debulking and Imiquimod for the Treatment of Nonresponsive Cutaneous Leishmaniasis J Am Acad Dermatol . 2017 Jan;76(1):e13-e14.